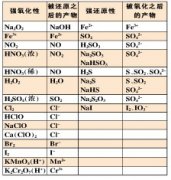
1.必须掌握的元素及其形成的具有强氧化性和强还原性的物质或离子
(1)高中新课程教材中所涉及的元素有:
Na、A、Fe、Cu、Si、N、O、S、Cl、Br、I
(2)元素形成具有强氧化性和强还原性的物质或离子的归纳:
强氧化性物质或离子:Na2O2、Fe3+、Fe(OH)3、Fe2O3、Fe3O4、NO、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、HClO、NaClO、Ca(ClO)2、Br2、I2、KMnO4(H+)、K2Cr2O7(H+)
强还原性物质或离子:Fe2+、FeO、Fe3O4、Fe(OH)2、FeS、FeS2、FeBr2、FeI2、CuS、Cu2S、Cu2O、CuH、SO2、H2SO3、Na2SO3、NaHSO3、H2S、Na2S、NaHS、Na2S2O3、NaI
(3)下表是你必须掌握的转化关系:(图一)
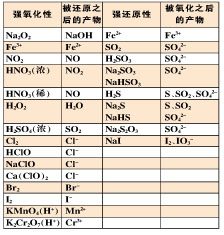
转化关系图
2.复杂的氧化还原反应离子方程式的书写方法——分解法(图二)
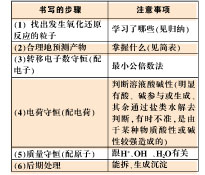
分解法
3.典型例题分析
例题:按要求书写下列反应的离子方程式:(1)写出Ca(ClO)2和SO2反应的离子方程式;(2)写出碱性条件下Cl2和Na2S2O3反应的离子方程式;(3)写出碱性条件下NaClO和FeSO4反应的离子方程式;(4)写出酸性条件下NO2和FeSO4反应的离子方程式;(5)写出HNO3(稀)和FeSO4反应的离子方程式;(6)写出酸性条件下KMnO4和FeSO4反应的离子方程式;(7)写出酸性条件下K2Cr2O7和FeSO4反应的离子方程式;(8)写出HNO3(稀)和FeS反应的离子方程式;(9)写出HNO3(稀)和Cu2S反应的离子方程式;(10)写出酸性条件下H2O2和FeSO4反应的离子方程式。
解析:(1)写出Ca(ClO)2和SO2反应的离子方程式:
第一步:找出发生氧化还原反应的粒子:ClO-和SO2
第二步:合理地预测产物:ClO-+SO2——Cl-+SO42-
第三步:配电子,由于ClO-→Cl-是得到2e-;SO2→SO42-是失去2e-,因此,得失电子已经相等了
第四步:配电荷,实际SO2是被氧化为H2SO4,写离子方程式时,H2SO4是要拆的,因此写成SO42-形式,因此该反应所产生的溶液是呈酸性的,用H+来配电荷,显然是加在生成物的一边,并且得加2个H+,即ClO-+SO2——Cl-+SO42-+2H+
第五步:配原子,反应是遵循质量守恒定律的,因此反应前后,相应原子个数要相等的,显然反应物的一边要加1个H2O,即ClO-+SO2+H2O——Cl-+SO42-+2H+。